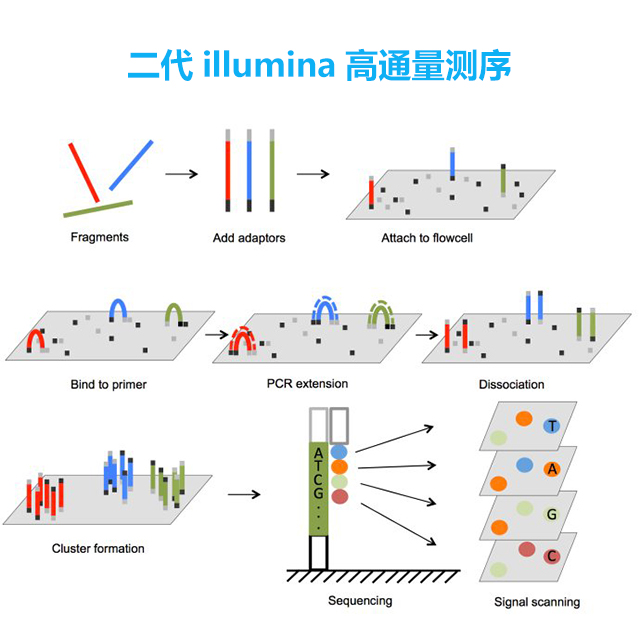
(1)DNA待测文库构建
利用超声波把待测的DNA样本打断成小片段,目前除了组装之外和一些其他的特殊要求之外,主要是打断成200-500bp长的序列片段,并在这些小片段的两端添加上不同的接头,构建出单链DNA文库。
(2)Flowcell
Flowcell是用于吸附流动DNA片段的槽道,当文库建好后,这些文库中的DNA在通过flowcell的时候会随机附着在flowcell表面的channel上。每个Flowcell有8个channel,每个channel的表面都附有很多接头,这些接头能和建库过程中加在DNA片段两端的接头相互配对,并能支持DNA在其表面进行桥式PCR的扩增。
(3)桥式PCR扩增与变性
桥式PCR以Flowcell表面所固定的接头为模板,进行桥形扩增,经过不断的扩增和变性循环,最终每个DNA片段都将在各自的位置上集中成束,每一个束都含有单个DNA模板的很多分拷贝,进行这一过程的目的在于实现将碱基的信号强度放大,以达到测序所需的信号要求。
(4)测序
测序方法采用边合成边测序的方法。向反应体系中同时添加DNA聚合酶、接头引物和带有碱基特异荧光标记的4中dNTP(如同Sanger测序法)。这些dNTP的3’-OH被化学方法所保护,因而每次只能添加一个dNTP。在dNTP被添加到合成链上后,所有未使用的游离dNTP和DNA聚合酶会被洗脱掉。接着,再加入激发荧光所需的缓冲液,用激光激发荧光信号,并有光学设备完成荧光信号的记录,最后利用计算机分析将光学信号转化为测序碱基。这样荧光信号记录完成后,再加入化学试剂淬灭荧光信号并去除dNTP 3’-OH保护基团,以便能进行下一轮的测序反应。Illumina的这种测序技术每次只添加一个dNTP的特点能够很好的地解决同聚物长度的准确测量问题,它的主要测序错误来源是碱基的替换,目前它的测序错误率在1%-1.5%之间,测序周期以人类基因组重测序为例,30x测序深度大约为1周。
illumina测序采用边合成边测序技术,在DNA片段两端加上序列已知的通用接头构建文库,文库两端的已知序列与Flowcell基底上的Oligo序列互补,每条文库片段都经过桥式PCR扩增形成一个簇,簇扩增及测序。与步骤二同时进行。即在碱基延伸过程中,每个循环反应只能延伸一个正确互补的碱基,根据四种不同的荧光信号确认碱基种类,保证最终的核酸序列质量,经过多个循环后,完整读取核酸序列。